Fantoompijn
Fantoompijn is een pijnsensatie die gevoeld wordt na het amputeren van een ledemaat, zoals een arm of been, maar het kan ook om een geamputeerde borst of getrokken kies gaan [1]. Een amputatie kan de volgende pijnlijke of niet pijnlijke neurologisch gevolgen tot stand brengen; fantoompijn, stomppijn en pijnsensaties [2] Fantoompijn kan in periodes voorkomen, maar kan ook chronisch zijn en kent veel verschillende vormen. Patiënten ondervinden vaak een brandend, prikkelend of pijnlijk gevoel in hun geamputeerde lichaamsdeel. Amputaties worden al millennia lang uitgevoerd. Het gevoel van fantoompijn en fantoomsensaties werd voor het eerst beschreven in de 16e eeuw door de Franse chirurg Ambroise Pare. Hij benoemde dat patiënten, lange tijd na hun amputatie, nog steeds pijn voelen aan hun geamputeerde lichaamsdeel. Hij beschreef dat zijn patiënten een sterk gevoel hebben van pijn en dat het nauwelijks voor te stellen is. De Amerikaanse neuroloog Silas Weir Mitchell gaf aan dit gevoel in 1871 de term ‘fantoompijn’. Hij beschreef de pijn die soldaten met geamputeerde ledematen hadden als een kwelling van de geest van de lichaamsdelen die waren geamputeerd [3].
Toch is fantoompijn nog een onduidelijk pijnsyndroom en wordt er nog onderzoek naar gedaan [4].
In dit naslagwerk wordt de pathofysiologie van fantoompijn beschreven. Hierbij komen de volgende punten aan de orde: de symptomen, de oorzaken en mechanismen van fantoompijn. Vervolgens wordt de therapie van fantoompijn beschreven.
Pathofysiologie
Oorzaken en epidemiologie
De grootste risicofactoren voor fantoompijn zijn amputaties van de onderste ledenmaten en bilaterale amputaties, bijvoorbeeld een amputatie van beide benen. Fantoompijn ontwikkelt zich in meer dan 75% van de gevallen binnen enkele dagen na de amputatie. Bij 60% van de gevallen blijft dit gevoel voor minstens één tot twee jaar bestaan [5]. Het aantal amputaties is niet bekend in Nederland, wel is een ruwe schatting gemaakt van de jaarlijkse gevallen in Nederland, namelijk ongeveer 32.000 arm- en beenamputaties [6]. Er kan alleen een voorspelling gedaan worden naar de incidentie van fantoompijn, omdat het niet samenhangt met leeftijd, geslacht en zijde of niveau waarop de amputatie heeft plaatsgevonden. Het is ook niet afhankelijk van de chirurgische of traumatische aard [7].
Symptomen
Fantoompijn wordt vaak geassocieerd met fantoomsensaties. Echter bestaat er een wezenlijk verschil tussen fantoompijn en fantoomsensaties. Fantoomsensaties worden gezien als het gevoel dat het lichaamsdeel, dat geamputeerd is, er nog is en wordt door bijna alle patiënten waargenomen. Fantoompijn is een pijngevoel in het geamputeerde lichaamsdeel en wordt door het merendeel van de patiënten die een amputatie hebben ondergaan, waargenomen.
Fantoompijn is dus te voelen bij de plek van de geamputeerde ledemaat of over de gehele ledemaat en is een ongemakkelijke en pijnlijke ervaring. Fantoompijn is onder te verdelen in nociceptieve pijn en neuropatisch pijn. De symptomen van nociceptieve pijn zijn gevoelloosheid, krampen en knijpen. De symptomen van neuropatisch pijn zijn scherp, schietende of elektrische prikkelende pijn [2]. Er bestaan verschillende soorten pijn en gevoelens die kunnen worden gekarakteriseerd als fantoomsensaties en fantoompijn. Ten eerste kan de patiënt het gevoel hebben dat het ledemaat er nog is, zoals zitten met een gebogen knie. Daarnaast kan de patiënt het gevoel hebben dat het geamputeerde lichaamsdeel nog steeds beweegt. Tot slot komen gevoelens van jeuk, pijn, hitte en een branderig gevoel veel voor bij patiënten met een geamputeerd lichaamsdeel. Een apart soort gevoel wordt ‘telescoping’ genoemd. Hierbij heeft een patiënt het gevoel dat het geamputeerde lichaamsdeel na een tijdje kleiner of korter wordt. Patiënten, waarbij een ledemaat is geamputeerd, hebben over het algemeen het gevoel dat hun fantoomledemaat ruimte inneemt die niet waarheidsgetrouw is. Deze kan worden gezien als een volledig verlamd lichaamsdeel dat door de amputees wordt beschouwd als onder eigen controle. Deze patiënten hebben vaak het gevoel dat de ledematen hun normale positie of houding langs het lichaam hebben, zoals voor de amputatie [8].
Mechanismen
De precieze neurologische werking van fantoompijn is op dit moment nog niet helemaal bekend en de werkingsmechanismen zijn op dit moment gebaseerd op experimentele observaties en theorieën. Er zijn op dit moment twee theorieën die fantoompijn kunnen verklaren. Dit zijn het perifere mechanisme en centrale neurale mechanisme, die weer is onderverdeeld in het supra spinaal mechanisme en spinaal mechanisme [1].
Perifeer mechanisme
Het perifere mechanisme ontstaat doordat tijdens een amputatie de axonen van de perifere zenuwen beschadigd raken. Die axonen initiëren een ontstekingsreactie waarbij neuroma’s gevormd worden. De afferente vezels in het neuroma ontwikkelen een ectopisch activiteit en worden gevoeliger voor catecholaminen. Tegelijk zal er een verhoogde accumulatie zijn van neurotransmitters waardoor er een upregulatie van spanningsafhankelijke Na+-kanalen en een downregulatie van K+-kanalen in neuroma’s ontstaan. De ontwikkeling van connecties tussen axonen die naar het ruggenmerg leiden worden vergroot. Die connecties kunnen spontane afferente innervatie tot stand brengen. De upregulatie van de spanningsafhankelijke Na+-kanalen leidt tot het gevoeliger worden voor prikkels en spontane ontladingen [1,2]. Deze veranderingen in het perifeer zijn een mogelijke oorzaak van spontane pijn. Daarnaast verklaren deze veranderingen waarom emoties of blootstelling aan kou pijn veroorzaken [2]. Er blijkt ook dat er sprake is van pijn. Dit komt door een reactie op een mechanische stimulatie van de beschadigde zenuw. Deze pijn wordt aangeduid als de ‘Tinel sign’ [5]. Fantoompijn via het perifere mechanisme treedt later op, omdat de neuroma’s nog gevormd moeten worden [6].
Centrale neuronale mechanisme
Het supra spinaal mechanisme heeft betrekking tot de reorganisatie van de somatosensorische cortex op de plek van de geamputeerde ledemaat. Dit houdt in dat het hersengebied die voor het geamputeerde lichaamsdeel correspondeerde wordt vervangen door een ander lichaamsdeel, voornamelijk het gezicht. Propiceptieve en nociceptieve innervatie van het gezicht nemen de plek over van de ledemaat in de somatosensorische en de motor cortex [2,4]. Doordat het gebied actief blijft na de amputatie interpreteert dat hersengebied dat het lichaamsdeel er nog is. Dit mechanisme blijkt de fantoomsensaties tot stand te brengen door de afferente nociceptieve stimulering van neuronen in de stomp of rondom de stomp [2,4]. Uit onderzoek is gebleken dat de omvang van de reorganisatie gerelateerd is aan de pijngraad [4]. In figuur 1 is schematisch weergeven hoe de reorganisatie verloopt.
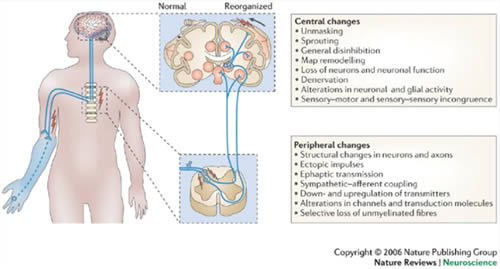
Tevens kan er door veranderingen aan het ruggenmerg pijnsensitisatie ontstaan dat vervolgens leidt tot fantoompijn. Pijnsensitisatie wordt veroorzaakt doordat een amputatie de activiteit van de NMDA receptoren, perifere pijnreceptoren, zal verhogen waardoor die activiteit tot een permanente verandering zorgen in de synaptisch structuur in de dorsale hoorn in het ruggenmerg [9]. Typische kenmerken van pijnsensitisatie zijn overgevoeligheid van de dorsale neuronen, de remming van inhibitoire processen, en structurele veranderingen aan de centrale zenuwuiteinden van de primaire sensorische neuronen, de interneuronen en de projectie neuronen [9]. Het heeft tot gevolg dat de overgevoelige neuronen verbonden raken met de dalende spinale projectie neuronen die bijdragen aan de impulsoverdracht van nociceptieve impulsen. Als de overgevoelige neuronen geprikkeld worden zullen de dalende projectie neuronen ook geprikkeld worden en zal er fantoompijn ontstaan.
Tenslotte zijn er ook voorstanders van de pijnherinnering-hypothese. Amputees hebben soms het gevoel dat de pijn in het geamputeerde lichaamsdeel even sterk is als de pijn die ze voelden in dat lichaamsdeel voordat de amputatie werd uitgevoerd. Het gaat om de herinneringen aan de pijn, voordat het lichaamsdeel werd geamputeerd. Deze herinneringen zouden een sterke fantoompijn kunnen veroorzaken. Deze fantoompijn zou veroorzaakt kunnen worden door veranderingen van de nociceptieve input in het centraal zenuwstelsel. Dit leidt vervolgens tot een verandering in het somatosensorisch systeem of cortex. In dit deel van de hersenen wordt de informatie afkomstig uit het lichaam verwerkt zoals tast-, pijn-, en temperatuurprikkels. Uit onderzoek is gebleken dat het verwijderen van de somatosensorische cortex leidt tot het wegvallen van de fantoompijn. Als iemand een herinnering krijgt die zijn oorsprong vindt in de spinale en supra spinale structuren, zoals het somatosensorisch systeem kan er vervolgens ongevoeligheid optreden [6]. Studies die deze hypothese ondersteunen concluderen dat chronische pijn, voordat de amputatie heeft plaats gevonden, een indicatie kan zijn voor de fantoompijn die iemand na de operatie zal ondervinden. Het gaat hier echter wel vaak over patiënten die langdurig last hebben gehad van pijn en waar de pijnherinnering zich dus ook lange tijd heeft kunnen ontwikkelen [6].
Therapie en behandeling fantoompijn
Er zijn verscheidene interventies mogelijk om fantoompijn voor een deel te beheren:
- farmacologische interventie
- psychologische interventie
- fysieke interventie
- gedragsmatige interventies
- chirurgische behandelingen
In een onderzoek van 30 jaar geleden bleek dat er meer dan 68 therapieën bestonden voor fantoompijn waarvan het merendeel niet eens significant effectief bleek te zijn. Hieronder wordt er een paar therapieën besproken die enigszins effectief blijken te zijn. In figuur 2 is weergegeven of de therapie supraspinaal, spinaal of perifeer aangrijpt.
Figuur 2: Weergave van de therapieën die aangrijpen op de supra spinale, spinale en perifere mechanisme. [1].

Spiegeltherapie
Spiegeltherapie is een niet chirurgische ingreep om fantoompijn bij patiënten met een amputatie te verminderen. Deze therapie werd als eerst gebruikt door Ramachandran in 1996. Bij deze therapie legt de patiënt zijn intacte ledemaat voor een spiegel, en zijn geamputeerde ledemaat erachter zoals te zien is in figuur3. Vervolgens voeren de patiënten bewegingen uit met hun intacte ledemaat, terwijl ze naar het spiegelbeeld van hun ledemaat kijken. Hierdoor ontstaat er een illusie van twee normaal bewegende ledematen. Door deze illusie wordt er een positieve feedback verstuurd naar de motor cortex, wat ervoor zorgt dat de pijncyclus verstoord wordt [10].
Het precieze werkingsmechanisme van spiegeltherapie is nog onduidelijk. Er wordt gesuggereerd dat het werkingsmechanisme berust op “mental imaging” of “motor imaging”. Mental imaging is het uitvoeren van een beweging door mentale voorstelling, zonder daadwerkelijk de beweging uit te voeren. Door deze handelingen uit te voeren met de intacte ledemaat, krijgen de hersenen de indruk dat het geamputeerde ledemaat weer normaal functioneert [11].

Er zijn verschillende richtlijnen voor de spiegeltherapie en voorlopig is er nog geen standaard. De behandelingsrichtlijnen binnen het Erasmus MC bestaat uit drie fasen, gebaseerd op de ideeën van Moseley.
Fase 1: Herkennen van afgebeelde ledenmaat.
Fase 2: In gedachten oefenen.
Fase 3: Oefenen met behulp van een spiegel.
Transcutane elektrische neurostimulatie(TENS)
TENS is een andere niet-invasieve methode. Bij TENS geven kleine elektroden die op het lichaam worden geplaatst elektrische prikkels af, die zenuwen stimuleren en de pijn verdoven. Er zijn een aantal theorieën die de werking van TENS proberen te verklaren. Eén daarvan is de gate control theory. Pijn wordt door zenuwvezels via het ruggenmerg naar de hersenen geleid. De prikkels van TENS worden ook zo doorgegeven. Doordat de cellen tegelijk door pijnprikkels als door niet-pijnlijke prikkels worden gestimuleerd, worden de pijnprikkels onderdrukt [12]. Een andere theorie is dat het lichaam wordt aangezet tot het produceren van bèta-endorfine, die een pijnstillende werking heeft [13].
Centrale stimulatie
Met centrale stimulatie wordt geprobeerd de corticale reorganisatie te beïnvloeden. Er wordt gebruik gemaakt van elektrische of magnetische signalen om het vuringspatroon van corticale neuronen te veranderen. Dit kan met een invasieve of niet-invasieve methode worden gedaan. Bij de invasieve methode worden elektroden boven de motor cortex geïmplanteerd. Een invasieve methode brengt altijd een risico op infectie of andere complicatie met zich mee. Er is dan ook een niet-invasieve methode. Bij transcraniale magnetische stimulatie worden magnetische spiralen gebruikt om een magnetisch veld te creëren dat elektriciteit induceert op een specifieke plaats in de cortex. Beide manieren blijken effectief te zijn in het verminderen van pijn bij sommige patiënten [14].
Elektrische stimulatie en sensorische discriminatie training
Elektrische stimulatie werd voor een lange tijd verondersteld effectief te zijn voor fantoompijn, ondanks het feit dat de meeste onderzoeken die dit bevestigden single-case studies waren. Er zijn verscheidene studies verschenen die vastlegden dat elektrische stimulatie beperkt effectief is [14].
Een van de therapieën waarvan de effectiviteit significant bleek te zijn was sensorische discriminatie training therapie. Bij sensorische discriminatie training is de bedoeling dat de patiënten de locatie en frequentie van de sensorische prikkels op de intacte ledemaat vermelden. Uit onderzoek is gebleken dat na 90 minuten sensorische discriminatie training het vermogen van de patiënt om prikkels vast te stellen op de intacte ledenmaat toeneemt, terwijl de fantoompijn op de geamputeerde ledemaat met 60% afneemt. Daarnaast vindt er normalisatie van de corticale reorganisatie plaats. Het is mogelijk om sensorische discriminatie therapie te combineren met andere therapieën. Het enige nadeel van sensorische discriminatie training is, is het verlies van gevoeligheid in de intacte ledemaat [14].
Farmacologische ingreep
De veel gebruikte pijnstillers, zoals paracetamol en NSAID’s, hebben meestal geen significant effect op fantoompijn. Er wordt tegenwoordig dan ook veel gebruik gemaakt van medicijnen die de prikkeloverdracht in het zenuwstelsel verstoren [15].
Een van de belangrijkste redenen van fantoompijn is de corticale reorganisatie van de hersenen. Er zijn verscheidene geneesmiddelen die dit proces verhinderen, en de corticale reorganisatie voorkomen en terugdraaien. Geneesmiddelen zoals NMDA-receptor antagonisten en GABA agonisten kunnen hierdoor fantoompijn bij patiënten verlichten. Daarnaast zijn er onderzoeken geweest die de korte termijn effectiviteit van ketamine aantonen [15].
Zenuwbeschadigingen zorgen voor het vrijkomen van verscheidene neurotransmitters, zoals glutamine, calcitonin gene-related peptide en substantie P, welk voor centrale sensibilisatie kunnen zorgen. NMDA-receptoren kunnen voor een verhoging van pijn intensiteit zorgen wanneer deze geactiveerd worden wanneer glutamine aan de receptoren bindt. Hierdoor leveren de NMDA-receptoren een bijdrage aan de centrale sensibilisatie. NMDA-receptor antagonisten kunnen dit proces blokkeren door de inhibitie van NMDA-receptoren.
Er zijn ook geneesmiddelen die effectief blijken te zijn, die geen directe effect hebben op de corticale reorganisatie. Zo zijn er patiënten die baat hebben bij het gebruik van lidocaïne [15]. Lidocaïne is een lokaal anestheticum dat werkt door onderdrukking van nociceptor sensibilisatie. Dit wordt gedaan door het niet-specifiek blokkeren van natriumkanalen [15].
Verder blijken opiaten, die vaak gebruikt worden bij neurotische pijn, ook een succes te zijn bij pijnverlichting van fantoompijn. Opiaten kunnen zich voordoen als endogene opiaten, zoals enkephalins, endorfines en dynorfines om de transmissie van pijn te reguleren en verhinderen [15].
Gebruik van een prothese
Er zijn verschillende typen prothesen die patiënten kunnen gebruiken afhankelijk van de plaats en de conditie van de overgebleven ledemaat.[14] Passieve prothesen zijn cosmetisch en bij een armprothese kan de patiënt daar alleen mee duwen, trekken, verschuiven en klemmen door gebruik te maken van de andere hand. Actieve prothesen hebben meer bewegingsvrijheid en kunnen aangestuurd worden door middel van lichaamsbekrachtiging, een externe krachtbron of allebei [16]. Helaas gebruiken de meeste patiënten hun prothesen niet regelmatig, omdat ze het niet nuttig vinden of omdat ze pijn krijgen aan de overgebleven ledemaat. Dat een patiënt met een controleerbare prothese minder pijn ervaart dan een patiënt zonder kan op dezelfde wijze als bij de spiegeltherapie verklaard worden. Er ontstaat een gevoel van eigendom voor de arm. In de studie van Lotze et al. werd beargumenteerd dat patiënten die hun actieve prothese gedurende de meeste tijd van de dag dragen en hun dagelijkse activiteiten daarmee verrichten minder pijn ervaren. Het onderzoek van Weiss et al. steunde dit met de bevindingen dat patiënten met een actieve prothese minder pijn hebben dan patiënten met een passieve prothese. Technologische verbeteringen in de kwaliteit van functionele prothesen zouden kunnen helpen bij het reduceren van de pijn bij patiënten [14].
[toggle title=”Referenties” state=”close”]
[1] Wikipedia. Fantoompijn. http://nl.wikipedia.org/wiki/Fantoompijn. Laatste keer bijgewerkt: 15-07-2013. Laatste keer geraadpleegd: 12-03-2014
[2] Hsu E, Cohen SP. Postamputation pain: epidemiology, mechanisms, treatment. J Pain Res. 2013;6: 121–136.
[3] Bittar BG, Otero S, Carter H, Aziz TZ. Deep brain stimulation for phantom limb pain. J Clin Neurosci. 2005;12(4):399-404.
[4] Subedi B and Grossberg GT. Phantom limb pain:mechanism and treatment approaches. Pain Res Treat. 2011;2011:1-8.
[5] Giummarra MJ. Gibson SJ. Georgiou-Karistianis N. Bradshaw JL. Central mechanisms in phantom limb perception: the past, present and future. Brain Res Rev. 2007;54(1):219–232.
[6] UPCM Zorgverleners. Fantoompijn. http://www.pijn.com/nl/zorgverleners/pijndiagnose/pijndiagnoses-per-regio/knie-enkel-voet/fantoompijn/. Gewijzigd op: onbekend. Geraadpleegd op: 26-02-2014.
[7] Kort Maar Krachtig. Informatie amputatie.http://kortermaarkrachtig.com/informatie/amputatie/. Gewijzigd op: onbekend. Geraadpleegd op: 26-02-2014
[8] Wikipedia, Phantom Pain. http://en.wikipedia.org/wiki/Phantom_pain. Gewijzigd op: 27-01-2014. Geraadpleegd op: 18-02-2014.
[9] Flor H. Phantom-limb pain: characteristics, causes, and treatment. Lancet Neurol. 2002;1(3):182-189.
[10] Kiabi FH, Habibi MR, Soleimani A, Zeydi AE. Mirror Therapy as an Alternative Treatment for Phantom Limb Pain: A Short Literature Review. Korean J Pain. 2013;3:309-311.
[11] Alderliesten-Visser HS, Selles RW, Melis-Schrijver L, Schreuders TAR. Spiegeltherapie, een illusie? NTVET. 2007;30-33.
[12] Medicinfo. Transcutane elektrische zenuwstimulatie. http://www.medicinfo.nl/%7Bd1f68cc0-2f67-4a89-8d12-d7e73ee9e100%7D. Gewijzigd op: 12-09-2008. Geraadpleegd op: 01-03-2014.
[13] Medisch centrum Leeuwarden. Folder fantoomgevoel en fantoompijn. https://www.mcl.nl/Downloads/4105/Fantoomgevoel%20en%20fantoompijn_december%202012.pdf. Gewijzigd op: onbekend. Geraadpleegd op: 01-03-2014.
[14] Foell J, Bekrater-Bodmann R, Flor H, Cole J. Phantom Limb Pain After Lower Limb Trauma: Origins and Treatments. The Int J of Low Extremity Wounds. 2011;10:224-230.
[15] Jun F, Yan-hong L, Kang-jie X, Shu-nu C. Pharmacological interventions for phantom limb pain. Chin Med J. 2013;126:542-546.
[16] Sint Maartenskliniek Nijmegen. Overzicht beschikbare prothesen. http://www.ispo.nl/upload/file/Linde%20ISPO-web.pdf. Gewijzigd op: onbekend. Geraadpleegd op: 01-03-2014.
[/toggle]